Elektrochemische Spannungsreihe
Elektrochemische Vorgänge
Um die wesentlichen Vorgänge der Elektrolyse besser verstehen zu können ist es sinnvoll, sich mit einigen chemischen und metallurgischen Basiskenntnissen zu beschäftigen. Begriffe wie Osmotischer Druck, Lösungsdruck oder die Elektrochemische Spannungsreihe tauchen in diesem Zusammenhang auf.
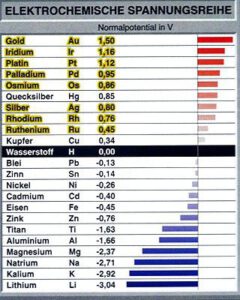
Lösungsdruck, Osmotischer Druck und Elektrochemische Spannungsreihe
Metalle sind die chemischen Elemente, die bei elektrochemischen Vorgängen oder chemischen Reaktionen, im Normalfall Elektronen abgeben. Sie werden dadurch zu Kationen, also positiv geladene Ionen. Die Nichtmetalle hingegen nehmen vorzugsweise Elektronen auf, wodurch sich Anionen (negativ geladene Ionen) bilden.
Zudem hat jedes Metall eine Neigung in strom- leitenden Flüssigkeiten, wie beispielsweise Salzlösungen oder Säuren, Kationen an die Flüssigkeit (Elektrolyt) abzugeben. Diese Eigenschafte nennt man den Lösungsdruck. Die Neigung Ionen aus einer Lösung aufzunehmen wird hingegen als osmotischer Druck bezeichnet. Je unedler ein Metall ist, umso größer ist der Lösungsdruck und entsprechend geringer ist der osmotische Druck. Bei Edelmetallen hat der Lösungsdruck hingegen nur einen minimalen Wert.
In der elektrochemischen Spannungsreihe werden die Metalle nach ihrer „Edelheit“ aufgelistet, das heißt nach der Spannung, die sich aufgrund der Ladungsverschiebung ergibt (Normalpotential). Durch die abgegebenen Ionen lädt sich das Elektrolyt positiv, was zur Folge hat, dass sich das Metall durch zurückbleibenden freien Elektronen negativ lädt. Dadurch kommt die Abgabe von Metallionen an die Lösung auch nach kurzer Zeit zum Stillstand. Daher stellt die elektrochemische Spannungsreihe ein wichtiges Hilfsmittel im Umgang mit elektrochemischen Prozessen dar.
Elektrochemische Korrosion
Ein weiteres Metall kann diesen beschriebenen Vorgang verhindern. Daher wird bei der sogenannten elektrochemischen Korrosion das unedlere von zwei Metallen, die gemeinsam in ein Elektrolyt getaucht sind, nach und nach vollkommen aufgelöst, sofern sich durch einen direkten metallischen Kontakt außerhalb des Elektrolyten ein geschlossener Stromkreis ausbilden kann. Je weiter die beiden Metalle in der elektrochemischen Spannungsreihe auseinander stehen, umso schneller vollzieht sich dieser Prozess. Das edlere Metall bleibt dabei völlig unangetastet. Außerdem wird bei diesem Vorgang eine elektrische Spannung und dadurch ein Stromfluss erzeugt. In Batterien und Akkumulatoren nutzt man dies technisch, bei metallischen Werkstücken dagegen wirkt sich die elektrochemische Korrosion störend auf die Beständigkeit der Waren aus.
Lötnähte laufen beispielsweise durch die Einwirkung von Luftfeuchtigkeit, Schweiß, Cremes usw. (Elektrolyt) schnell an, weil sie unedler sind als das Grundmetall. Das Gleiche gilt auch, wenn man einen goldenen Ohrstecker mit einer silbernen Ohrmutter (oder umgekehrt) sichert. Das Silberelement läuft schnell an.